「炎症回路」の活性化が多くの病気の発症につながっています(村上正晃インタビュー①)
近年、様々な事実が明らかになってきた免疫分野の中で、とりわけキーワードになるのが「炎症」。体を守るはずの炎症の働きが低レベルで慢性的に続くことで、自己免疫疾患をはじめ、ガンやメタボなど様々な病気の引き金になる? 今回インタビューに登場する村上正晃氏(北海道大学遺伝子病制御研究所所長・教授)は、こうした諸病の原因となる「慢性炎症」の重要なファクターとして、神経系(交感神経系)→ストレスを結びつけた研究を精力的に行っている。すなわち、ストレスによる神経系への局所の刺激が慢性炎症を起こす……免疫系と神経系をつなげる村上氏の研究はきわめて刺激的だ。これまで語られることの少なかった「炎症・ストレス・交感神経」のつながりをふまえつつ、人がどのようなプロセスで病気にかかるのか? 最新科学が明らかにした事実を2回にわたってお届けしたい。今回はその第1回。
■免疫系と神経系をつなげる研究
村上 今日はどんなふうにお話していけばいいですか?
――まず、先生の研究分野についてお話ください。大学の研究室のホームページには「分子神経免疫学」と書かれていますが、具体的にどのような研究になるのでしょうか?
村上 対象としているのは炎症で、最近では特に神経刺激との関係を研究しています。炎症と言っても幅広く、ほとんどの病気がここに関わってきます。病気のメカニズムを解明するうえでも、「炎症がどうして生じるか?」ということがとても重要になってくるんです。
――免疫学の分野でいま非常に注目されている概念だと思いますが、一般的には炎症というと急性炎症がイメージされますよね。
村上 もともと炎症というのは、創傷治癒に関するものですからね。たとえば、蚊に刺された時の炎症は、蚊から入った成分を体から除去するために起こる免疫の働きです。本来、必要があって働くものなのですが、オフにできないまま低レベルの炎症が長く続くと、病気の発症につながってしまいます。
――いわゆる「慢性炎症」と呼ばれるものですよね。先生の研究は、そうした炎症のどういった点を対象にされているんですか?
村上 2008年に、炎症のメカニズムの基盤になるものを発見して、その機構は発見した当初は「IL-6アンプ」と呼んでいたんですが、いまは「炎症回路(炎症アンプ)」と名称を変えました(図1)。その炎症回路が、じつは局所的に神経系で制御されていることが、私たちの研究でわかったんです。
――それで「分子神経免疫学」という名前が……。
村上 そうですね。もともとは「分子免疫学」が研究室の名称でしたが、新たにそこに「神経」が入ったんです。もしかすると、近々「心理免疫学」に変えるかもしれませんが(笑)。
――炎症回路のメカニズム解明を機に、「神経」が入ったんですか?
村上 炎症回路のメカニズムを発見したのが2008年、神経系の制御については「ゲートウェイ反射(Gateway Reflex)」と呼んでいますが、こちらは2012年に発見しています。教室の名称が「分子神経免疫学」に変わったのは、2014年からですね。
――なるほど。ところで、免疫について調べていく中で、ここ数年、「炎症」というキーワードと出会う頻度が増えている気がするんですが……。
村上 流行っていますよね(笑)。
――慢性炎症が生活習慣病やメタボリック症候群の発症にもつながっている……いや、我々が病気と呼んでいるものの多くは炎症がカギになっているという印象を持っています。
村上 そう思います。私たちの研究では「炎症回路が……」という形で論文発表していますが、炎症回路が自己免疫疾患をはじめ、メタボリック症候群、アルツハイマー、パーキンソン病、ALSを含む神経変性疾患、あるいはアトピー、アレルギーなどの多くのヒト疾患に関わっているということは、2013年に証明しています(図2)。
精神疾患についても、てんかんや統合失調症のように、もともと免疫との関係が指摘されていたものはありますが、全体で見るとあまり関連づけられてなかったですよね。私たちはそうした精神疾患との関わりも証明しましたから、多くの病気に炎症回路が関係していると言って間違いないと思います。
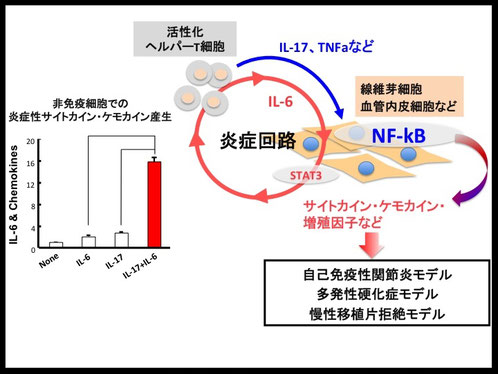
↑図1・「炎症回路」の概略図
1型コラーゲン陽性の非免疫細胞(線維芽細胞、血管内皮細胞など)においてNF-κBとSTAT3経路が同時に活性化されることで、過剰なNF-κBシグナルの活性化が誘導され、IL-6をはじめとした炎症性サイトカインやケモカイン、増殖因子が産生される「炎症回路」の機構が活性化される。
ここで産生されるIL-6は炎症回路の持続的活性化において中心的な役割を担うサイトカインである。また、炎症回路の活性化により産生されたサイトカイン・ケモカインは、様々な炎症性疾患モデルの発症を誘導する。
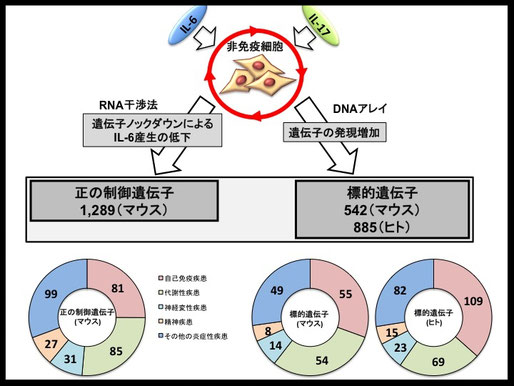
↑図2・炎症回路に関与する3つの遺伝子リスト
shRNAシステムを用いたRNA干渉法により炎症回路の制御遺伝子群を、DNAアレイにより炎症回路の標的遺伝子群を同定。それらの遺伝子群をヒトの疾患関連遺伝子「GADデータベース」と比較することにより、実際に炎症回路関連遺伝子群には多くの疾患関連遺伝子が含まれることが明らかになった。ヒトの疾患として、自己免疫疾患のほかメタボリックシンドロームに代表される炎症性代謝性疾患、神経変性疾患、ガン発生に関連するものも多く含まれていた。これらの結果は、炎症回路が実際にヒトの様々な疾患において重要な分子基盤であることを意味する。
■「炎症」がガンを悪化させている
――体の中では、たえずホメオスタシス(恒常性)が働いていますが、様々な理由でそうした生体バランスが崩れていく過程で過剰な炎症反応が起き、炎症を抑えようとする免疫の働きが上手く機能しなくなる……病気の実態を捉えるうえでこの点がカギになると考えてよろしいですか?
村上 そうですね。実際に炎症回路が活性化するためには、サイトカイン、増殖因子、神経伝達物質など多くの液性因子が刺激剤になります。いま話題のレギュラトリーT-cell(制御性T細胞、Tレグ細胞)などは、サイトカインを出すような活性化ヘルパーT細胞や、Cd-8のキラーT細胞などの働きを抑えますから辻褄は合いますよね?
――本来は、このあたりがバランスよく機能しているわけですよね?
村上 ええ。炎症回路をネガティブにする機構としては、転写因子で言えばNF—κB(エヌエフ・カッパー・ビー)が活性化することで炎症は起こりますが、このNF—κBを抑えるSocs3 、A20なども知られています。
――たしか、A20は喘息などに関係していると聞いたことがありますが……。
村上 ガンにも関係していますので、炎症回路の関連するガンの関連遺伝子としてのA20について、2013年に論文に書いています。
――ガンの要因に炎症というキーワードを入れても差し支えない?
村上 問題ないですね。実際、炎症がガンを悪くするのだと思います。少なくとも炎症回路のこの部分がガンを悪くしそうだというのがあって、いま、製薬会社と薬を作れないかと研究しているところです。
――先ほど出たTレグ細胞の場合、免疫寛容が関係していますよね? ということは腸管免疫も炎症の除去に関わっている? 一般的には腸の健康が全身の健康に寄与しているという、ざっくりした言い方になりますが。
村上 (図3を指しながら)Tレグ細胞は、ここのT細胞(Th1、Th17)を抑えるからサイトカインが減るんですね。Tレグの発生というのは、特に普通のTレグの場合、TGF-βというサイトカインやTCR(T細胞受容体)の刺激によって出てくるのですが、Th17はTCRとTGF-βにIL-6の刺激があると出ます。だから、TレグとTh17の発生というのは、環境にIL-6があるかどうかの違いしかない。Tレグへの分化を抑えるもののメインはおそらくIL-6で、Th17は腸管で特に多いんです。
――Th17って炎症性のT細胞ですよね?
村上 ええ。私たちもTh17を念頭に置いてこの炎症回路を見つけたので、やはりTレグとの関連はいつも意識していますね。
――なるほど。免疫が過剰に働きすぎるとアレルギーや自己免疫疾患になりますよね? そこに炎症が関わっているのはわかりますが、メタボなどの代謝系の疾患に関わっているという点はどう考えればいいのでしょうか?
村上 Tレグ細胞がメインに抑えるのは、活性化したヘルパーT細胞なんですね。このヘルパーTは、サイトカインをたくさん出しますから炎症性ですよね。私自身、サイトカインが体の中で局所的に増えたり、全体的に増えたりすることがメタボのような病気につながると思っています。しかも、このヘルパーT細胞は加齢とともにどんどんと活性化します。
――加齢とともに活性化するのはなぜですか?
村上 サイマス(Thymus 胸腺)が小さくなることが原因の一つですが、なぜ小さくなると活性化するかというと、T細胞というのは結構賢くて、T(サイマス)の量を合わせようとするんですね。そうするとナイーブな活性化していないT細胞が徐々に活性化します。それは、自己反応性とかなりリンクしているんです。
だから、年をとって自己免疫疾患が増えるというのはとてもリーズナブルなことで、TCRの認識がどんどん自己に近づいていくというのはわかっています。
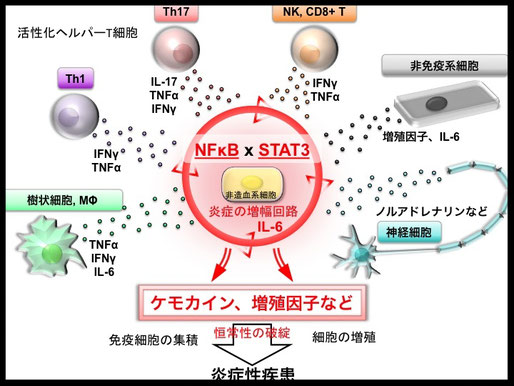
↑図3・「炎症の増幅回路」の刺激物質と炎症疾患の誘導
多くの炎症回路の研究から炎症回路を活性化する刺激物質は、活性化したへるぱーT細胞、NK細胞、キラーT細胞、樹状細胞、マクロファージから産生される様々なサイトカインばかりではなく、様々な増殖因子群、神経伝達分子などもあることがわかってきた。これらの因子は、炎症局所にて非免疫系細胞に働いてNFkBとSTAT3の同時活性化からIL-6、ケモカイン、増殖因子などの炎症性の因子を大量に局所産生して、無秩序に様々な免疫細胞を集積、周囲の細胞を増殖させ、その部位の恒常性を破綻させて、炎症を誘導して、炎症性疾患の発症を導く。
■「痛み」によって局所の炎症回路が活性化する
――年をとるほどに自己免疫疾患が増えるというのは、ある意味で必然だと。
村上 はい、それはT細胞の恒常的分裂と言います。年をとればとるほど活性化し、メモリー型のT細胞が増えていくんですね。メモリーT細胞が病気に関連するというのは、MHC(主要組織適合遺伝子複合体)クラスIIにリンクする病気で、じつは私たちの研究している炎症回路ともかぶっている病気と言えるんです。そういう意味で言えば、炎症回路はこうしたサイトカイン・ディペンデント(=依存した)な病気を引き起こすヘルパーTの下流の機構であると言っていいと思います。
――ただ、サイトカインが出ること自体は自然な体の反応のひとつですよね?
村上 そうです。
――だから悪いわけじゃなくて、そこに何かたぶん免疫系のリズムが乱れてしまうような要因があって、サイトカインが増えざる得ない状況がある?
村上 もちろんです。生活習慣というか……たとえば肥満にしても、脂肪細胞がどんどん増えて、そこからもサイトカインが出ますからね。あと、私たちが注目しているのが局所の神経の刺激で、これがかなり大きい影響を与えていそうです。
――ああ、先ほどおっしゃった神経の刺激ですね。
村上 ええ。特に交感神経ですね。だから、いつもピリピリしていると交感神経がいつも活性化してくるので、そうなると局所的にノルアドレナリンが出て、炎症回路自体がかなり過剰に回るようになります。サイトカインだけの場合より、そこにノルアドレナリンが加わったほうが炎症回路の活性化が激しくなります。
これは、2012年に重力刺激からの交感神経の活性化で、腰髄の部分の血管が変化する“重力ゲートウェイ反射”という事象を見出しました(図4)。この結果の続きとして、2018年には私たちのマウスが宇宙ステーションに行くことも計画されています。また、面白いことに、筋肉を微弱な電気で刺激すると局所的に感覚神経―交感神経のクロストークが誘導できるのですが、それによって、脊髄でのゲートの位置が変化することも証明しています(図5)。
――交感神経、ストレスが過剰になると炎症が増加してしまうということですね。
村上 そうです。私たちが次に証明したのは、痛みですね。そこにストレスも関わってきますが、この痛みの刺激を導入すると脊髄のお腹側の2本の血管が特異的に変わります(図6)。私たちは中枢に注目しているのですが、胃、肝臓、腎臓などの一般臓器でもいずれかの部位の血管が変化する可能性もあります。こういうことは、すでにわかっているんです。
――血管の(免疫細胞のための)ゲートが開くという言い方をされていますね。これって、日常的などこかぶつけた時の痛みではないですよね?
村上 慢性的な痛みですね。慢性的ということが重要で、それがおそらく慢性炎症にも通じるものだと思います。たとえば、歯が痛いとか……。女性に自己免疫が多いひとつの理由は、女性にそういう周期的痛みがあるからかもしれません。
――いわゆる生理痛とか。
村上 ええ。だからそういう慢性的な痛みでどこかの血管で炎症回路が活性化し、そこで炎症がどんどん起こるような状況にはなっていると思いますね。
――なるほど。身近な例になりますが、肩こりのような慢性痛も炎症に関係しているのでしょうか? 肩こりがひどい人はかなりいますが、なかなか治らず、ずっと悩んでいるじゃないですか? それもサイトカインが関係を?
村上 交感神経が活性化することで、どこかの部位の血管で炎症回路が活性化し、IL-6とかグロースファクター(成長因子)、ケモカインなども出ますので、(肩こりの場合も)炎症が関連している可能性はあると思います。
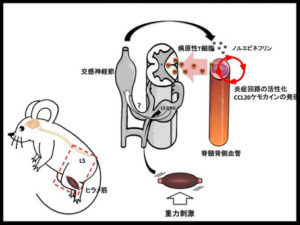
↑図4・「重力ゲートウェイ反射」
マウスのヒラメ筋に対する持続的な重力刺激は感覚神経の活性化を誘導する。感覚神経の細胞体はL5の後根神経節(L5 DRG)に存在し、近傍の交感神経活性化を引き起こす。活性化した交感神経はL5の脊髄背側血管に投射しノルエピネフリンの産生を増加させる。ノルエピネフリンは血管内皮細胞における炎症回路を活性化することでゲートが形成され、病原性T細胞が中枢神経系へ侵入する。
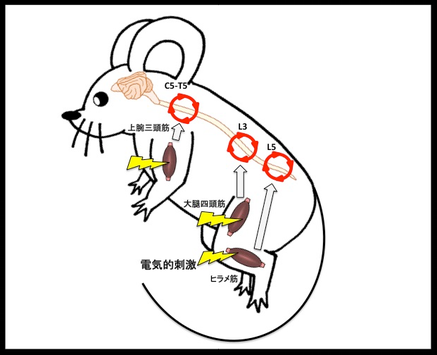
↑図5・「電気ゲートウェイ反射」
人為的な電気刺激を筋肉に加えることで感覚神経と交感神経のクロストークが生じ、刺激された筋肉の部位に応じた脊髄レベルにおいて、脊髄背側血管での炎症回路の活性化とともに新たなゲートが形成される。
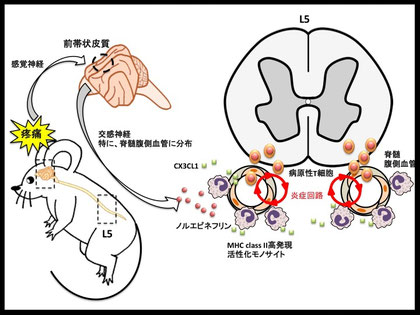
↑図6・痛みと神経の病気の関わり「疼痛によるゲートウェイ反射」
疼痛刺激により誘導された感覚神経の活性化に引き続き、交感神経、特に脊髄腹側血管に分布するものの活性化が惹起される。この交感神経の活性化により、脊髄腹側血管の近傍へのノルエピネフリン濃度が上昇。移入EAEモデルの寛解期では、L5レベルにおいて多くのMHC クラス2高発現の活性化モノサイトが残存しており、交感神経より放出されたノルエピネフリンは、これら活性化モノサイトからのCX3CL1の産生を促す。CX3CL1はオートクライン、パラクライン的に作用しL5脊髄への活性化モノサイトを集積させ、当該血管にて抗原提示を引き起こして病原性T細胞の侵入を促進。その結果、近傍の腹側血管における炎症回路が亢進し、さらなる免疫細胞の侵入を促す。
■ストレス、痛みで特定の血管が変わる
――肩こりだけに限定して語るのは難しいと思いますが、ストレスが様々な慢性疾患に関わっていることが、将来的にもっとわかってくるかもしれませんね。
村上 そうですね。すでにストレスがどこの血管を変えるかは証明しました。ストレスをかけるとある特定の血管が変わって、ある神経回路が過剰に働きだして病気になることがわかっています。
――血管のある部位ですか?
村上 部位です。全身的に血管が変わるわけじゃない。何かのストレス、痛みで変わる血管の特定の部位は、少なくともマウスでは決まっていました。
――なるほど。生きている限りストレスはあり、生活リズムが狂うこともありますが、血管の状態が変わるかどうかの分岐は微妙なように思います。つまり、健康でいられる人が完璧なわけでもないし、すごく不規則だからと言って必ずしも病気になるわけではない。
村上 そうですね。だから誘因があって、少なくとも私たちの系だとT細胞ですね。T細胞の中にある程度自己反応性の強いTがあって、その自己反応性の強いTが認識する抗原に個人個人で少しずつ偏りがあって、それが認識する特定の臓器抗原があります。その時、何かの原因でその臓器の血管が開くと危ない状態になるのかもしれません。自己反応性T細胞の血中での存在と、それが認識する抗原を持つ臓器の血管が開く、その二つが重なった時に病気になる可能性は高いと思います。
――それは、一人一人の体質みたいなものなんですか?
村上 先ほど話したように、加齢とともに自己反応性が増しますが、その時の個人ごとに抗原が乗るMHCが違い、乗っている自己ペプチドも違いますから、そこでバリエーションは出てくると思います。それに反応しやすいTがどこの臓器の抗原を見るか、各個人でやはり少しずつ違いますよね。
――なるほど。いろいろと健康に気をつけていても、どうしても病気になりやすい人となりにくい人がいます。そこを、どうやって上手く説明するかだと思うんですが。
村上 そこは難しいですね、いろんな可能性がありすぎて……。自己反応性Tができやすい人もいますし、交感神経が活性化しやすい人もいる。私たちの研究から言うと、最終的には、非免疫系の細胞でNFカッパーB(NF-κB)の活性化が起こりやすい人が病気になりやすいかもしれませんね。
――それぞれ違う。どこかの割合が強い人とか……。
村上 生体の恒常性というのはいろいろなバランスで成り立っていますから、それこそいろいろな可能性があると思います。逆に難しくなりましたね(笑)。
――いえいえ。体質なんて言い方をすると、ちょっと簡単すぎるかもしれないなと……。
村上 いやいや、体質ですよ。体質でいいと思いますよ。
――そう言うしかない?
村上 そう言うしかない。たとえば、いわゆるSNPs(スニップス)解析で判明した病気の関連遺伝子って、今ではいっぱい知られているじゃないですか。個々の疾患関連遺伝子のその病気を誘導する危険率というのは、普通は2倍にいかないんですよ。
MHC、特にMHCクラス2遺伝子は例外ですが、複数の病気の関連遺伝子の、そうした少しずつの危険率の積み重ねがあって、それがまさに体質ですよね。病気が起こるかどうかの差もそこだと思いますよ。それらの遺伝子のいくつかのものは、炎症回路の関連遺伝子であったり、神経活性化に関連する遺伝子かもしれません。
◎村上正晃 Masaaki Murakami
1993年、大阪大学大学院医学研究科博士課程修了。北海道大学免疫科学研究所助手、コロラド大学客員准教授、大阪大学大学院医学系研究科助教授、大阪大学大学院生命機能研究科准教授などを経て、現在は北海道大学遺伝子病制御研究所、同大学院医学研究科教授、北海道大学遺伝子病制御研究所所長、大阪大学大学院生命機能研究科および大阪大学免疫学フロンティア研究センター招聘教授を務める。また、2017年4月には、国立大学共同研究・共同利用評議会会長を拝命。専門は神経免疫学、特にゲートウェイ反射。神経刺激による炎症回路の形成、神経と免疫との相互作用などについて研究を続け、最近は分子レベルの“心理免疫学”の創設を目指して研究を行っている。
編集協力/野口久美子
投稿者プロフィール
最新の投稿
 長沼ブログ2023.11.21嫌なこと=悪いこととは限らない
長沼ブログ2023.11.21嫌なこと=悪いこととは限らない 長沼ブログ2023.11.14悩みが一瞬で気にならなくなる方法とは?
長沼ブログ2023.11.14悩みが一瞬で気にならなくなる方法とは? 長沼ブログ2023.11.10行き詰まった人生を一変させる意外な視点とは?
長沼ブログ2023.11.10行き詰まった人生を一変させる意外な視点とは? 長沼ブログ2023.11.07「腹が座る」ってどういうことだろう?
長沼ブログ2023.11.07「腹が座る」ってどういうことだろう?




